

 政策历史沿革
根据公开信息,此次李强总理签署国务院令公布的《条例》,相关部委已经过历时六年准备:国家卫健委在2019年2月发布并公开征求意见的《生物医学新技术临床应用管理条例(征求意见稿)》(以下简称“《征求意见稿》”);同年9月在多个高校网站公布了《生物医学新技术临床研究和临床转化应用管理条例(草案)》扫描版文件(和本次审议通过文件同名,以下简称“《条例扫描版》");后几经沉寂,在年初公布的最新《国务院2025年度立法工作计划》中,《生物医学新技术临床研究与转化应用管理条例》已被列为拟制定或修改的行政法规之一。2025年9月12日的国务院常务会议上,会议审议通过《生物医学新技术临床研究和临床转化应用管理条例(草案)》。
政策历史沿革
根据公开信息,此次李强总理签署国务院令公布的《条例》,相关部委已经过历时六年准备:国家卫健委在2019年2月发布并公开征求意见的《生物医学新技术临床应用管理条例(征求意见稿)》(以下简称“《征求意见稿》”);同年9月在多个高校网站公布了《生物医学新技术临床研究和临床转化应用管理条例(草案)》扫描版文件(和本次审议通过文件同名,以下简称“《条例扫描版》");后几经沉寂,在年初公布的最新《国务院2025年度立法工作计划》中,《生物医学新技术临床研究与转化应用管理条例》已被列为拟制定或修改的行政法规之一。2025年9月12日的国务院常务会议上,会议审议通过《生物医学新技术临床研究和临床转化应用管理条例(草案)》。
正式稿相较于征求意见稿突出体现了监管的科学性和高效性,后续需关注卫健委的配套实施文件,期待具体实施标准&细则。
政策内容关键价值解析 1.明确生物医学新技术定义,提供清晰的应用管理边界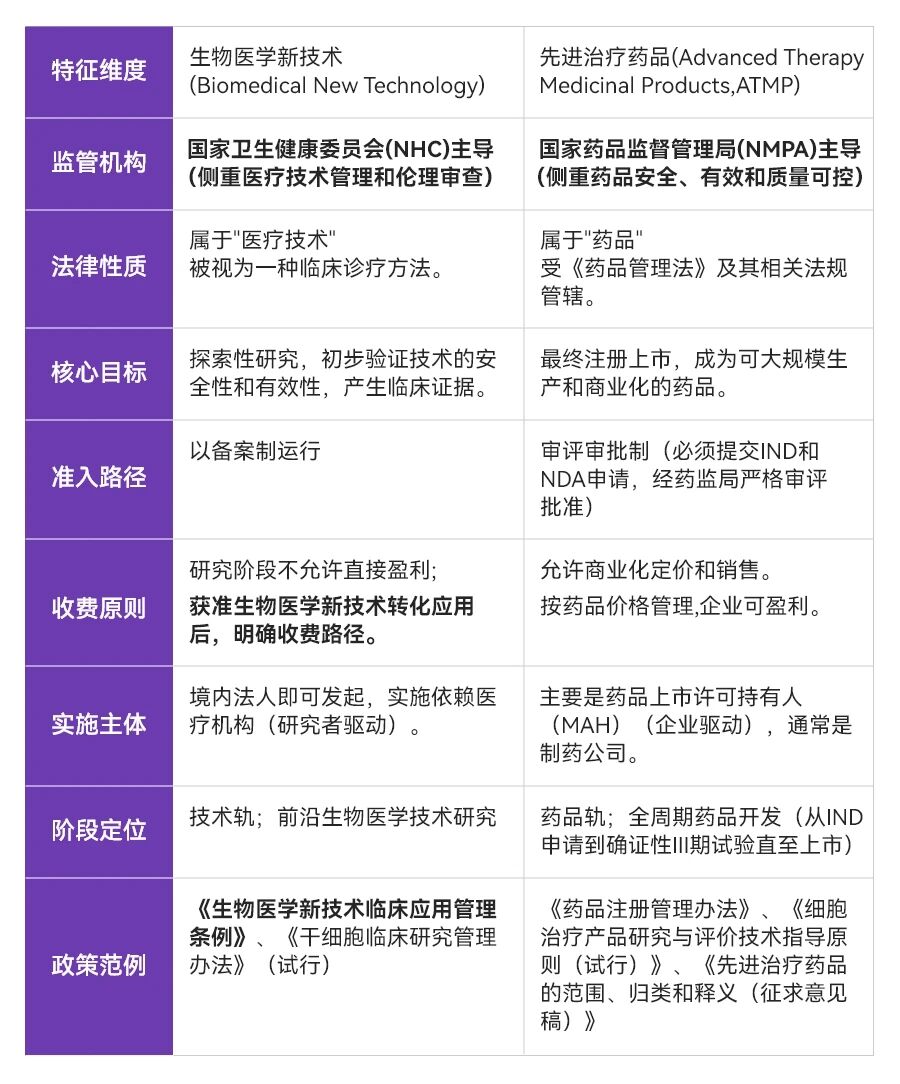 既往相较于药品轨完善的定义规范、开发流程以及监管审批标准,技术轨往往落入为之服务的附属角色;伴随着《条例》的出具及法规完善,技术轨监管支持下同样建立了合规清晰的早研-临床研究-转化应用商业化的闭环结构。双轨制的独立并行发展为企业策略上带来了更加丰富的选择,进一步激活创新型企业的活力和行业创造性。
既往相较于药品轨完善的定义规范、开发流程以及监管审批标准,技术轨往往落入为之服务的附属角色;伴随着《条例》的出具及法规完善,技术轨监管支持下同样建立了合规清晰的早研-临床研究-转化应用商业化的闭环结构。双轨制的独立并行发展为企业策略上带来了更加丰富的选择,进一步激活创新型企业的活力和行业创造性。
摘自网址:http://www.360zhyx.com/home-research-index-rid-81435.shtml